
-
2025-7-29
淺談實驗動物獸(shòu)醫的“獨立性”
-
2025-7-22
五領域模(mó)型的演化與升(shēng)級
-
2025-7-15
從“五自由”到“五領域” — 動物福利理念的升級之路
-
2025-7-8
檢測到陽性結果,然後呢?
-
2025-7-1
獸醫(yī)急診中的動物狀態評估
-
2025-6-24
舔一口的風險
-
2025-6-17
齧齒類實驗動物常見的蠕蟲(chóng)
-
2025-6-10
實驗動(dòng)物關護文化(huà)的核心特征
-
2025-6-3
中(zhōng)心靜脈導管(CVC)在實(shí)驗研(yán)究中的應(yīng)用
-
2025-5-27
五大自由的(de)缺(quē)陷
滴眼給(gěi)藥毒性(xìng)試驗(yàn)1-目的與試驗設計
滴眼給藥毒性試驗的目的
滴眼給藥毒性(xìng)試驗是重複給藥一般毒性試驗,主要用於研發滴眼藥(yào)物。歐盟發布的《醫療用品非(fēi)臨床局部耐受性試驗指導原則》(CPMP/SWP, 2001)明確規定了單次給藥和重(chóng)複給藥眼部耐受性試驗的相關事宜(yí)。美國食品藥品監(jiān)督管理局發布的《藥品以及可替代性給藥藥品非臨床(chuáng)安(ān)全性評價指導原則草案》(FDA/CDER, 2008)則明確要求在滴眼給藥時應(yīng)開(kāi)展(zhǎn)係統藥代動力學(PK)和眼科檢查(包括裂隙燈顯(xiǎn)微(wēi)鏡檢查、眼底(dǐ)檢查、眼壓測量及組織病理學檢查)。然而,這兩份指導原則中的(de)相關規定均較簡要,缺乏滴眼給藥毒性試(shì)驗詳細設計的具體內容(róng)。目前,尚無滴眼給藥毒性試驗的(de)確切定義。日本(衛生福利(lì)部,1999)依據ICH M3指導原則(zé)(ICH, 2009)和ICH S4指導原則開展滴眼給(gěi)藥毒性試驗。這些原則通常(cháng)適用於係統給藥的藥物。
有人常常將滴(dī)眼給(gěi)藥毒性試驗與眼刺激試驗混為一談。實際上,滴眼毒(dú)性預試驗、一周(zhōu)或兩周的(de)重複給藥(yào)滴眼毒性試驗的方案與眼(yǎn)刺激試驗的方案有(yǒu)相似之處(OECD, 2012)。
目前,眼刺激試驗通常(cháng)使用兔子(zǐ)進行,以評估化學物質在粘膜給藥或人體偶然接觸時的安(ān)全性(OECD, 2012)。眼(yǎn)刺激試驗的主要目的(de)是檢測眼表的刺激或腐蝕反應。
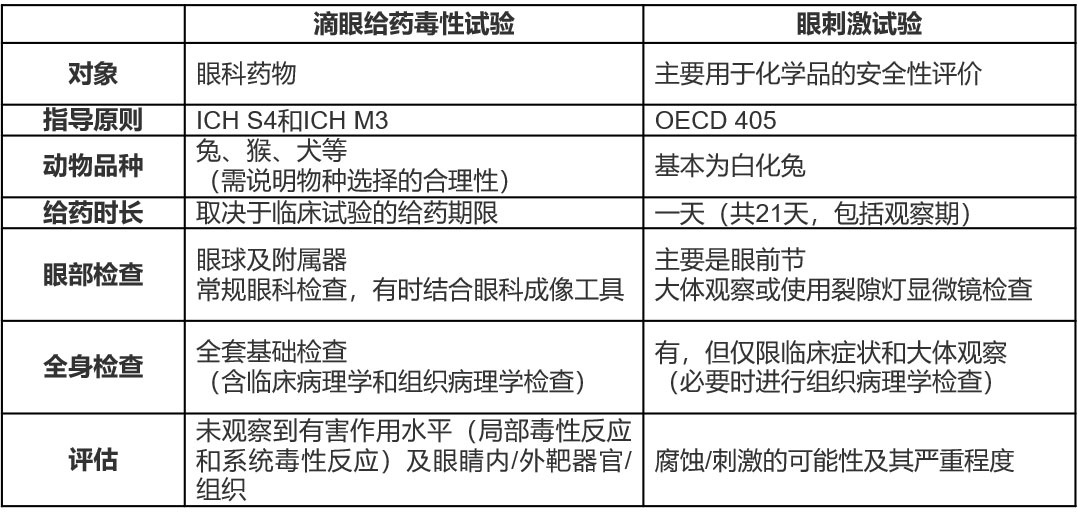
相(xiàng)比之下,滴眼給(gěi)藥(yào)毒性試(shì)驗的主要目(mù)的(de)是評(píng)估眼科藥物的一般毒(dú)性。因此,滴眼給藥毒(dú)性試驗(yàn)的檢查項目包括組織病(bìng)理(lǐ)學檢查、眼部附屬器以及全身髒器的評價。這兩種試驗的差異見(jiàn)表1。
表1 滴眼給藥毒性試驗和眼刺激試驗的差異
滴眼給藥毒性試驗的設計(jì)
01、動物物種
根據(jù)ICH M3指導原則,一般毒性試驗需(xū)選擇兩種(zhǒng)動物(ICH, 2009)。通常情(qíng)況下(xià),會從齧齒類動物(如兔或小鼠(shǔ))和非齧(niè)齒(chǐ)類動物(犬或猴)中各選(xuǎn)一種。然而,在過去十年間(2005~2016),經日本衛生勞動福利部(MHLW)批準,約九(jiǔ)成的滴眼液在研發過程中,將兔作為開展滴眼給藥毒性試(shì)驗(yàn)的(de)首選實驗物種,其次常用的實驗物種是(shì)猴(幾乎全部是(shì)食蟹猴),再然後是犬(見表2)。因(yīn)此,滴眼給藥毒性試驗(yàn)通常選擇(zé)兩種非齧齒類動物。不過,動物物種的選擇是根據具體情況而定的。因此,在評估某些藥物時,可能僅(jǐn)使用一個物種(比如兔或食蟹猴)。
表(biǎo)2 2005~2016日本滴眼液滴(dī)眼給藥毒性試驗的獲批的動物物種
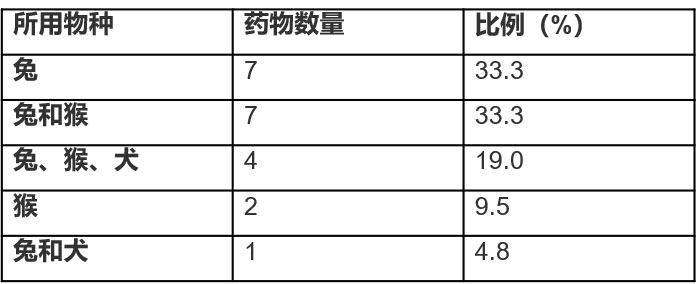
注:信息來源(yuán)於日(rì)本醫藥和醫療器械(xiè)局(jú)(PMDA)主頁
近來發表的多篇文章從眼部(bù)安全性(xìng)評(píng)估的角度出發,討論了各個實驗物種的特點,並對不同實(shí)驗物種作了比較。各物種的特點如下。
兔
兔的眼球(qiú)重量約為人眼的一半,眨眼頻率(每6分(fèn)鍾一次)明顯(xiǎn)低於人類的(de)眨眼頻率(每(měi)5秒鍾一次)。此外,兔的角膜比人(rén)類的角(jiǎo)膜薄。基於這些特點,並考慮到影(yǐng)響藥物角膜滲透能力的因素,有研究者預計,在滴入滴眼(yǎn)液後,兔眼的藥物暴露水平相對較高。McDonald和Shadduck(1977)認為兔相較於其他實驗動物對眼刺激物更為敏感。使(shǐ)用兔進(jìn)行試驗的其他原因還包括較低(dī)的動物成本以及基於大量供試(shì)品積累的曆(lì)史數據。
在進行(háng)滴眼給藥毒性試驗(yàn)時,特別需注意選擇色素兔還是白化兔。由於供(gòng)試(shì)品能夠與色素兔體內的色素(sù)結合,因此在毒性評估時(shí),色素兔更具(jù)優勢。關於色素兔(tù),荷蘭帶兔比新西蘭大白兔和新西蘭紅兔(F1代兔)更(gèng)常用於(yú)滴眼給(gěi)藥毒性試驗。Durairaj等人(2012)報告稱,人(rén)、食蟹猴、犬、豬、F1代兔和荷蘭帶兔的眼部黑(hēi)色(sè)素含量存在差異(yì),而且不同物種之間眼睛各部分的黑色素含(hán)量也不同。另外,值得(dé)一提的(de)是,荷蘭帶兔(tù)的眼球比新西蘭大白兔(tù)或日本白兔的小。
猴
盡管食蟹猴的眼球重量僅約為人眼的(de)一半,但其解剖(pōu)特征與人類相似。例如,食蟹猴的角膜和晶狀(zhuàng)體相(xiàng)對較小,眼底有黃斑。Shibuya等人(2015)建議將食蟹猴用作實驗動物,因(yīn)為它(tā)們的眼睛有助於詳細評(píng)估藥物誘(yòu)導的黃斑病變毒性。食(shí)蟹(xiè)猴的眨眼頻率與人類相似。與人類一(yī)樣,食蟹猴(hóu)既沒有瞬膜,也沒有哈氏腺,而兔、犬和(hé)豬(zhū)則都有瞬膜和哈氏腺。食蟹(xiè)猴和犬(quǎn)一樣,也用於係(xì)統毒性試驗。利用相關物種可以獲得毒理學數據,彌合局部給藥和係統(tǒng)給藥在同一物種中產生的結果差異。與人類相比,食蟹猴的(de)眼組織黑色素含量相對較高。在猴類中,視神經退化常見於恒河猴和食蟹猴,且(qiě)被認為是自發性先(xiān)天視神經病變。
犬(quǎn)和豬
針對特定目的飼養的比格犬(quǎn)的眼球重量約為(wéi)5.5克,約為人眼重量的0.8倍,而(ér)豬的眼球大小接近人眼。從眼球(qiú)的絕對尺寸來看,犬和(hé)豬在藥物局部效應(yīng)評估方麵具有優勢,因為眼組(zǔ)織的厚度和長度是決定局部給藥藥物滲透性和分布的(de)重要因(yīn)素。犬(quǎn)和豬的眼部解剖特征相似,例如,與靈長類動物相比,它們的晶狀體在眼球中占據的體積相對(duì)較大。另一方麵,犬的脈(mò)絡膜上有毯氈層,而豬(zhū)、兔或食(shí)蟹猴則沒有。目前,犬和豬不常用於滴眼給藥毒性試驗,尤其(qí)是豬。然而,這類(lèi)動物在滴眼給藥毒性試驗中仍有其獨特的優勢,理由如下:1. 基於上述解剖和生理特點,模仿(fǎng)人體藥物分布的可能性較高。2. 與兔和食蟹(xiè)猴(hóu)相比,由於犬和(hé)豬(zhū)的體型相對較大,通過係統給藥出(chū)現的藥物反應更少。
02、性別
根據一般毒性試驗指導(dǎo)原則(衛生福利部,1999),滴眼給藥毒性試驗應在兩種性(xìng)別的動物上進行。人類、恒河猴和兔的眼軸(zhóu)長度存在性別(bié)差異,但眼球尺寸的性別差(chà)異卻極其微小。Wagner等人(2008)研究了健康人眼和患病人眼的性別(bié)差異,認為性激素影響了不同性別在患病狀態下的淚腺係統、眼瞼和眨眼頻率(lǜ)、以及角(jiǎo)膜的解剖和特征。一般而言,幹眼(yǎn)流行病(bìng)學研究表明女性幹眼發病率比男性高(gāo)。然而(ér),實驗動物的眼睛是否存在顯著(zhe)的性別差異(yì)尚不明確。是否(fǒu)在滴眼給藥毒性試驗(yàn)中使(shǐ)用兩種性別,尤(yóu)其(qí)僅進行眼毒性評估的試驗,仍有待進一步討論。
03、給藥
劑量和濃度
根據(jù)ICH M3指(zhǐ)導原則(ICH,2009),一般毒性試驗的高(gāo)劑量水平設定為最大耐受量(MTD)、最大給藥量(MFD)或人體暴露量的(de)50倍。這一設定原則(zé)同樣適用於滴眼給藥毒性試驗。在某些情況下,高劑量水平可以基於局部(bù)耐受(shòu)性預試驗的結果(guǒ)來確定。然而(ér),在大多數情況下,滴眼給藥毒性試驗的(de)高劑量水平是根據MFD設(shè)定的,主要是(shì)由於製劑(jì)製備的某些內在因素。
供試品的(de)角膜滲透性主要取決於製(zhì)劑的特性。為了獲得有意(yì)義的風險評估結果,權威性滴眼給藥毒性試驗(例如首次人體試驗之前開展的GLP試驗(yàn))所用的供試製劑應與臨床試驗所用(yòng)的製劑(jì)一致或相近。供試品(pǐn)的濃度主要是根據(jù)其在製劑中的溶解度來定義的。至於製劑的調整,其他特性(如滲透壓、pH值和(hé)賦形劑)也十分(fèn)重(chóng)要。滴眼液製劑的酸堿度應在(zài)可接受的生理範圍內。選擇防腐(fǔ)劑時,需避免其濃度達到引起毒性反應的水平。例如,有研究者發現,眼科製劑中常用的(de)防腐劑苯紮氯銨(ǎn)在局部給藥時會誘發角膜變化。因此,眼科製劑中(zhōng)防腐劑的濃(nóng)度是有限(xiàn)製的。因此,在(zài)大多數情況(kuàng)下,滴眼給藥毒性(xìng)試(shì)驗所設(shè)的最(zuì)高劑量水平是基於(yú)受試製劑的最大給藥量,而非供試(shì)品本身的特(tè)性(xìng)來決定的(de)。
滴眼(yǎn)體積(jī)
兔子的眼(yǎn)瞼較為鬆弛,結膜囊較大,因此能容納較(jiào)大的滴眼液體積。根據OECD眼刺激試驗(yàn)指導原(yuán)則,兔子的滴眼體積為0.1 mL(OECD, 2012)。該體積約為(wéi)臨(lín)床標(biāo)準(zhǔn)滴眼液用藥體積(jī)(約0.04 mL)的兩倍。從經驗(yàn)來看,不同物(wù)種的最(zuì)大滴眼體積並不相同。例如(rú),比格犬(quǎn)和兔子的最大可行體(tǐ)積相似(sì),而食蟹猴的最大可行體積(jī)則是比格(gé)犬(quǎn)和兔子的兩倍多。
需(xū)注意的是,眼部(bù)暴露量(liàng)並不會隨著滴眼體積的增加而成比(bǐ)例增加,因為部分多餘的液體會通(tōng)過鼻(bí)淚管流失。Lambert等(1993)假定(dìng)在眼刺激試驗中,如果滴眼體積為(wéi)0.01 mL(建議供試體積的十分之一),藥物與(yǔ)人眼刺激(jī)感受的相關性更佳。因(yīn)此,滴眼給藥毒性試驗的滴眼(yǎn)體(tǐ)積可能(néng)需進一步討論。增加滴(dī)眼體積並不能有效提高眼部暴露量,反而可(kě)能導致係統暴露量增加,甚至引發意料之外的係統毒性反應。
單眼/雙眼給藥
供試品是單眼給藥還是雙眼給藥需慎重考慮。從動物福利的角度出發,若無特殊原因,應將供(gòng)試品滴入單側眼(yǎn)睛。如一隻眼給予供試品,另一隻眼(yǎn)則不給藥(即不接觸供試(shì)品),或給予對(duì)照(zhào)品(例如溶媒製劑)作為對照。然而,嚴格來說,對(duì)照眼由於(yú)係統循環的影響,可能也會接觸到供試品(pǐn)。因此,在評(píng)估對照眼(yǎn)的結果時,應該考慮到這一潛在的接觸因素。
給藥(yào)頻率
在標準的口服(fú)或靜脈給藥一般毒性試驗中,通常每天給藥一次;而在(zài)滴眼給藥毒性試驗中,通常一天給藥多次。非臨床試(shì)驗的滴眼頻率通常高於臨床試驗的給藥頻率。例如,非臨床試驗中可能每天滴(dī)眼4次,而臨床試驗中則每天滴眼2次。滴眼給藥毒性試驗設定較高的給藥頻率,旨在獲得更高的重複暴露量,特別是在(zài)供(gòng)試品的(de)生化特征導致最大藥物濃度難以增加時更為重要。Chrai等人(1974)報告稱,如果兩次(cì)滴眼間隔(gé)5分鍾,就(jiù)能有效地增加兔的眼部暴露量(liàng)。許多滴眼給藥毒性試驗(yàn)的給藥頻率是臨床給藥頻率(lǜ)的1.5到2倍。然而,給藥過(guò)於(yú)頻(pín)繁雖可提高暴露水平,但也增加操作的次數,從而增加動物保定的頻率,這可能導致動物應激(jī),進而引發倫理問題。因此,在設計滴眼給藥毒性(xìng)試(shì)驗時(shí),需在提(tí)高暴露水平和減少動(dòng)物應激之間(jiān)找到平衡點,以確保試驗的科學性和倫理性。
04、眼及(jí)附屬(shǔ)組織檢查
常規/標準眼科學檢查
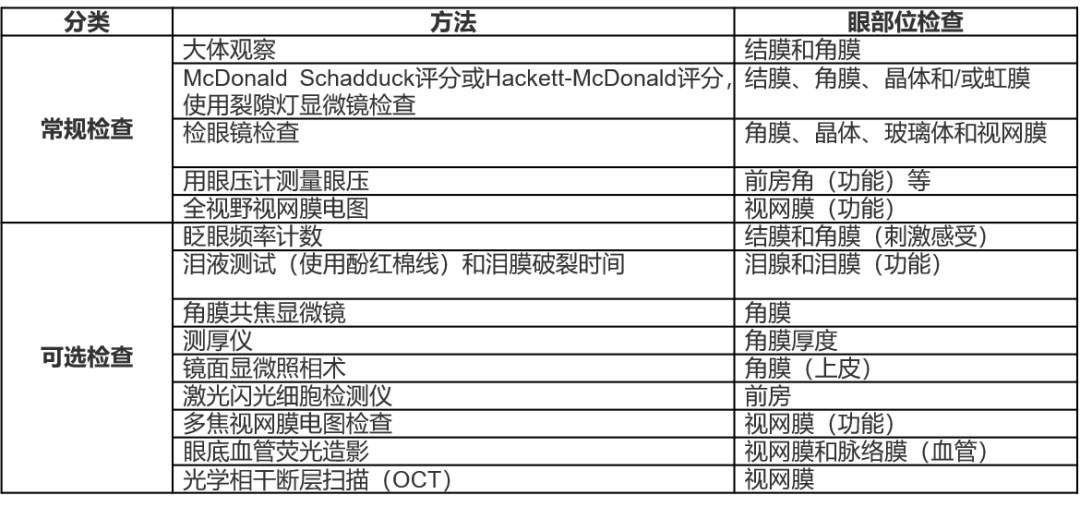
滴眼給藥毒(dú)性試驗目前尚(shàng)無統一的眼部和係統檢查項目(mù)。OITSs的眼科學(xué)檢查(chá)是(shì)基於(yú)係統(tǒng)藥物一般毒性評估指導原(yuán)則(zé)進行(háng)的(de),涵蓋了(le)眼前節(jiē)、眼內介質和(hé)眼底等所有組織的檢查(ICH, 1999)。然(rán)而,由於滴眼給藥直接作用於眼部,滴眼給藥毒性試驗的眼科(kē)學(xué)檢查更加(jiā)詳細,涵蓋的檢查項目也更多。Weir和Wilson(2013)列出(chū)了(le)非(fēi)臨床眼(yǎn)毒(dú)性試驗的(de)標準眼部安全(quán)性終點,這些終點(diǎn)具有重要的借鑒意義。檢查項目包括:大體觀(guān)察、裂隙燈生物顯微鏡檢查、眼底檢(jiǎn)眼鏡檢查、眼壓測量、視網膜電圖和組(zǔ)織病理學。
基於相關(guān)指導原則和知識,表3總結了滴眼給藥(yào)毒性試驗的常規及(jí)可選(xuǎn)眼科檢查項目(mù)。由於(yú)眼前節的供試品濃(nóng)度較高,因(yīn)此對(duì)眼前節進行(háng)觀察和檢查尤為重要。除(chú)標準的大體觀察外,采用評分方(fāng)法進行詳細觀察對於評估眼毒性的(de)嚴重程度(dù)非常關(guān)鍵。例如,Draize評(píng)分法用(yòng)於角膜、虹膜和結膜的大體觀察。McDonald Schadduck評分(fèn)和Hackett-McDonald評分常應用(yòng)於滴眼給藥毒性試驗(yàn)中,二者對裂隙燈顯微鏡檢查結果進行評分。特別是,Hackett-McDonald評分能對眼睛進行全麵評估,包括對晶體和瞳(tóng)孔光反射的評估。
表3 滴眼給(gěi)藥毒性試驗的常規或可選眼科學檢查
常規檢查包括利(lì)用檢眼鏡對玻璃(lí)體和眼底進行觀察。使用直(zhí)接檢眼鏡和間(jiān)接檢眼鏡可詳細檢查眼底。本原則建議,除拍照(zhào)外,還應簡述檢查結果並記錄,並將這些記錄與相應的詳細記錄一同保存。
眼壓(yā)是衡量前房角功能變化(huà)的重要參數。FDA指導原則提到了使用眼(yǎn)壓計的方法(FDA/CDER,2008)。在非臨床毒性試驗中,常用扁平眼壓計、回彈式眼壓計或空氣式眼壓計(jì)來測量眼壓。在(zài)滴眼給藥毒性(xìng)試驗(yàn)中,使用眼壓計(jì)有幾點注意事項。首先,為了獲得準確的眼壓值,有必要使動物適應眼壓計。在測量之前(qián),如果動(dòng)物沒有適應眼壓計,通常情況下測出的眼壓值會偏高(gāo),從而導致無法正確判(pàn)斷藥效。其次,由於儀器會接觸角膜表麵(miàn),眼壓測量操(cāo)作可能會在某種程度上(shàng)損傷角膜上(shàng)皮細胞(bāo)。因此,應慎重決定檢查的組別及檢查順序,以避免眼部過度應激,並防止過度(dù)應激影響其他結果的解讀。
通過全視野視(shì)網膜電圖檢查(chá)(ffERG)可檢(jiǎn)測視網膜的功能變化。理想的做法是使用國際臨床視覺電生理協會(ISCEV)建議的方法,因為此方法可在進行全視野視網(wǎng)膜電圖檢(jiǎn)查時識別視錐細胞和視杆細胞的變化。然(rán)而,此方(fāng)法不適用於在有限時間內對大量動物進行檢查(chá)的情況。ISCEV方(fāng)法擬用於(yú)隨診檢查,可能僅適用於ERG檢查發現異常(cháng)的情況。例如,Penha等人(2010)報告稱,角膜(mó)混(hún)濁或晶體混濁會影(yǐng)響光線到達視網(wǎng)膜,而麻醉也會影響全視野視網膜電圖的檢查結果。
可選(xuǎn)檢查
關於淚膜檢查,Schirmer試驗和酚紅線試驗用於(yú)淚液體積的定量分析。進行Schirmer試驗和酚紅線試驗(yàn)時(shí),分別使(shǐ)用無毒濾紙或棉線浸潤於pH指示劑酚紅溶(róng)液中,然後(hòu)插入結膜囊內進行淚膜檢測。淚膜的其他臨床檢查包括淚膜破裂時間。此前已有研(yán)究者報告了犬和兔的淚膜(mó)破裂時間,這些測試(shì)能夠揭示淚腺(xiàn)的功能狀態。此(cǐ)外,眨眼頻率也可以(yǐ)間接說明供試品是(shì)否對角膜產生了刺激。
由於眼科成像技術的進步,現在能檢(jiǎn)測出常規眼科學檢查難以察覺的變化。例如,角膜共焦顯微鏡檢查能夠捕捉到角膜上皮的細微變化;角膜內(nèi)皮顯微鏡(jìng)檢(jiǎn)查能(néng)夠觀察到角(jiǎo)膜內皮的形態和密度變化;光學相幹斷層掃描(OCT)對於視網膜的觀察非常有力。這些成像技術均可用於滴眼給藥毒性試驗中的動(dòng)物檢查,能夠生成高分辨率的圖像,滿足組織病理學檢查的要求。
滴眼給藥毒性試驗的其(qí)他常用眼前節檢查包括定量測量角膜厚度的測厚儀和定量測量前(qián)房房水閃輝(huī)的激(jī)光房水閃光細胞(bāo)儀。如果眼後(hòu)節的視網膜出現局部異常,多焦視網膜電圖(mfERG)能夠捕捉到相應的電生理信號。利用眼底血管熒光造影能夠觀察(chá)到視網膜和脈絡膜的原有血管(guǎn)及新生血(xuè)管(guǎn)的滲透性。
Kontadakis等人(2014)指(zhǐ)出,淚膜中的細胞因子和生長(zhǎng)因子作為生物標記物,能預示(shì)眼表疾病。有研究者報告稱,血清細胞因子是預示老年黃斑變性的生物標記物。生物標記物能用於非(fēi)侵入性方式觀察藥物誘導的眼毒性(xìng)反應。然而,目前這樣的生物標記物數量仍然有(yǒu)限。反過來,上述(shù)的各種眼部成像技術可能可(kě)替代生物標記物,用於觀察和研究人和動物的眼毒(dú)性。
05、眼及附屬組(zǔ)織的病(bìng)理學(xué)檢查
組織病理檢查是滴眼給藥毒性試驗的(de)重要組成部分。最近,多篇(piān)文獻綜述(shù)一致強調(diào)了組織(zhī)病理學檢查在藥物評(píng)估(gū)中的重要性。在滴眼(yǎn)給藥(yào)毒性試驗中,供試品(pǐn)的(de)最大暴(bào)露量不僅出現在角膜上皮,還出現在結膜和排泄係統(tǒng),包括鼻淚管的粘膜和鼻腔。因此(cǐ),需要特別注意細致檢查這些組織。淚腺(xiàn)、哈氏腺(若有)、鼻(bí)腔和瞬膜(若有)也應進行組(zǔ)織病理學檢查(chá)。為了準確地進行組織(zhī)病理學評(píng)估分析,必須嚴格考量組織病理切片的質(zhì)量(liàng)。如今已(yǐ)有多(duō)篇關於這一方麵的(de)文章發表,詳細闡(chǎn)述了切片的各種技術考量。


